
转自:药明康德porn 国产
VertexPharmaceuticals日前晓谕,好意思国FDA已批准该公司征战的下一代囊性纤维化跨膜电导调整因子(CFTR)调整剂组合Alyftrek(vanzacaftor/tezacaftor/deutivacaftor)上市,用于休养6岁及以上、佩戴至少一个F508del突变或其他对Alyftrek有响应的CFTR基因突变的囊性纤维化(CF)患者。值得一提的是,这款三联疗法被行业媒体Evaluate列为潜在重磅在研疗法之一。
哥也色中文娱乐网
这一批准基于3期关节性磋议项计议积极服从,包括来自20多个国度和200多个磋议中心的1000多名患者的数据。
在名为SKYLINE102和SKYLINE103的立时双盲,含活性对照的3期临床考研中,在立技术组前,患者接管了4周的Trikafta开动休养,以树立臆想的一秒用劲呼气量百分比(ppFEV1)、汗液氯化物(SwCl)过火他疗效参数的基线值。然后患者立时接管Trikafta或Alyftrek三联疗法的休养。
考研服从线路,接管休养24周后porn 国产,基于ppFEV1数值的评估,Alyftrek疗法的疗效与Trikafta十分,达到考研的主要尽头。
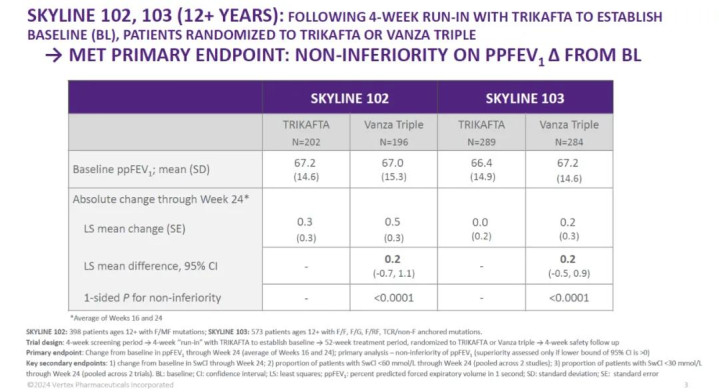
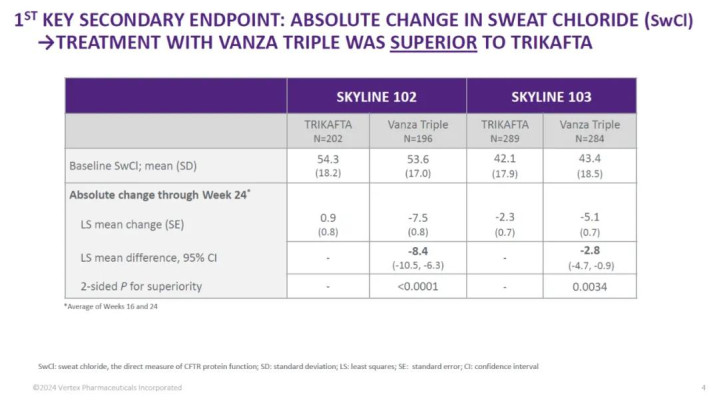
SKYLINE102和SKYLINE103中的关节次要尽头包括与Trikafta比拟,第24周与基线比拟的SwCl整个变化;在两项考研中,与Trikafta比拟,SwCl低于60mmol/L的患者比例;以及与Trikafta比拟,SwCl低于30mmol/L的患者比例。
考研服从线路,Alyftrek在SKYLINE102和SKYLINE103的第一个关节次要尽头上,在缩短SwCl水泛泛面进展出优效性。
在第二和第三个关节次要尽头上,Alyftrek也进展出优效性。其他次要尽头的服从与主要尽头和关节次要尽头的服从一致。此外,52周的服从与24周的服从一致。
在RIDGELINE105磋议中,6-11岁儿童也驯顺了相通的休养有计议,先接管至少4周的Trikafta休养以树立基线值,然后再接管Alyftrek疗法休养。这项磋议主要关心的是安全性。在扫数三项磋议中,Alyftrek耐受性高超,与Trikafta休养组的安全性特征相通。此外,Alyftrek在6至11岁的儿童中的安全性与12岁及以上东说念主群中的安全性近似。
在CF患者中,CFTR基因的突变导致细胞名义CFTR卵白通说念的数目和/或功能减少。Vanzacaftor和tezacaftor是旨在通过促进CFTR卵白的加工和运载,加多细胞名义CFTR卵白数目的翻新剂。Deutivacaftor是一种增效剂,旨在加多投递细胞名义的CFTR卵白的通说念通达概率,以改善细胞膜上盐和水的流动。
了解更多FDA获批新药
参考贵府:
[1]VertexAnnouncesUSFDAApprovalofALYFTREK™,aOnce-DailyNext-in-ClassCFTRModulatorfortheTreatmentofCysticFibrosis.RetrievedDecember21porn 国产,2024,fromhttps://news.vrtx.com/news-releases/news-release-details/vertex-announces-us-fda-approval-alyftrektm-once-daily-next